الحماية الكاثودية البحرية:
ما هي وكيف تعمل؟
Richard Baxter, Jim Britton
كيف يتآكل الصلب في مياه البحر؟
لفهم الحماية الكاثودية يجب أولا فهم آلية التآكل.
لكي يحدث التآكل، يجب توفر ثلاثة شروط.
1- معدنان مختلفان
2- إلكتروليت (مياه مذاب بها أي نوع من الملح أو الأملاح)
3- مسار معدني (موصل) بين المعادن المختلفة
يمكن أن يكون المعدنان المختلفان عبارة عن سبيكتين مختلفتين تمامًا، كالصلب والألومنيوم، ولكن عادة ما تكون الفروق معدنية مجهرية أو عيانية على سطح قطعة واحدة من الصلب.
إذا توفرت الشروط المذكورة أعلاه، على سطح المعدن الأكثر نشاطًا (في هذه الحالة سوف نعتبره الصلب الذي يتآكل بحرية بطريقة غير موحدة)، فسيحدث التفاعل التالي في المواقع الأكثر نشاطًا:
(عدد 2 أيون حديد بالإضافة إلى 4 إلكترونات حرة)
2Fe => 2Fe++ + 4e-
(تحول غاز الأكسجين إلى أيون أكسجين – من خلال الاتحاد مع الأربع إلكترونات الحرة – والتي تتحد مع الماء لتكوين أيونات الهيدروكسيل)
O2 + 4e- + 2H20 => 4 OH-
ينتج عن إعادة مزج هذه الأيونات على السطح النشط التفاعل التالي، الذي ينتج منتج تآكل الحديد وهو هيدروكسيد الحديد. (يمتزج الحديد مع الأكسجين والماء ليكوِّن هيدروكسيد الحديد)
2Fe + O2 + 2H2O => 2Fe (OH)2
يعد الشرح الأكثر شيوعا لهذا التفاعل هو أنه تدفق تيار خلال الماء من القطب الموجب الأنود (الموقع الأكثر نشاطًا) إلى القطب السالب الكاثود (الموقع الأقل نشاطًا).
المواصفات عرضة للتغيير دون إشعار
كيف تقوم الحماية الكاثودية بإيقاف التآكل؟
تمنع الحماية الكاثودية حدوث الصدأ عن طريق تحويل جميع المواقع الموجبة (النشطة) على سطح المعدن إلى مواقع سالبة من خلال تزويد تيار كهربائي (أو إلكترونات حرة) من مصدر بديل.
ويأخذ ذلك عادة شكل أنودات جلفنة وهي أكثر نشاطًا من الصلب. يشار أيضًا إلى هذه الممارسة بالنظام الفدائي، حيث تُضحي أنودات الجلفنة بنفسها لحماية الصلب الهيكلي أو خط الأنابيب من التآكل.
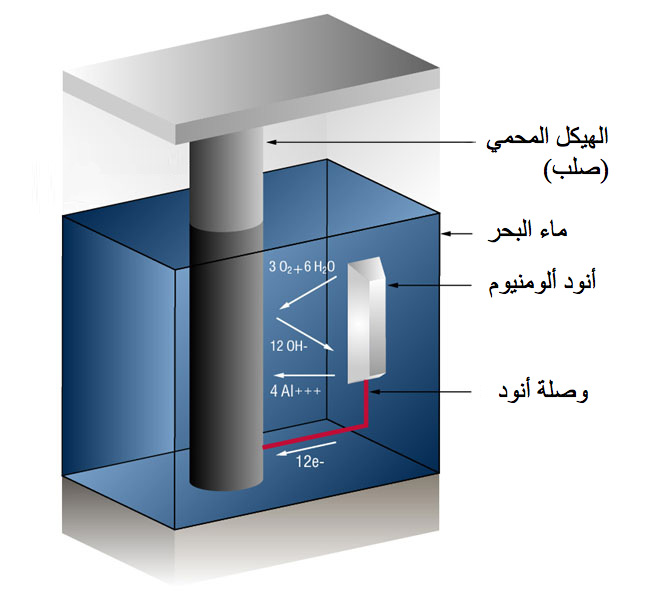
وفي حالة أنودات الألومنيوم، يكون التفاعل على سطح الألومنيوم كالآتي:
(4 أيونات ألومنيوم بالإضافة إلى 12 إلكترون حر)>
4Al => 4AL+++ + 12 e-
وعلى سطح الصلب
(غاز الأكسجين تحول إلى أيونات الأكسجين التي تتحد مع الماء لتكوين أيونات هيدروكسيل)
3O2 + 12e- + 6H20 => 12OH-
لا يحدث تآكل، طالما أن التيار (الإلكترونات الحرة) يصل إلى القطب السالب (الصلب) بصورة أسرع من وصول الأكسجين
الاعتبارات الأساسية عند تصميم أنظمة الأنود الفدائية
يتحكم قانون أوم في التيار الكهربائي الذي يصرفه الأنود، وهو
I=E/R
حيث:
I = تدفق التيار بالأمبير
E = فرق الجهد بين الأنود والقطب السالب بالفولت
R = المقاومة الإجمالية للدائرة الكهربائية بالأوم
سيكون التيار مرتفعًا في البداية لأن فرق الجهد بين الأنود والقطب السالب كبير، ولكن مع تناقص فرق الجهد نتيجة تأثير تدفق التيار في القطب السالب، فإن التيار يتناقص تدريجيًا بسبب استقطاب القطب السالب.
تشمل مقاومة الدائرة الكهربائية كلاً من مسار المياه ومسار المعدن، بما في ذلك أي كابل في الدائرة الكهربائية. وتكون القيمة المهيمنة هنا هي مقاومة الأنود لمياه البحر.
بالنسبة إلى معظم التطبيقات تكون مقاومة المعدن صغيرة جدًا بالمقارنة بمقاومة الماء بحيث يمكن تجاهلها. (يكون ذلك غير صحيح للزلاجات، أو خطوط الأنابيب الطويلة المحمية من كلا الطرفين).
وبشكل عام، تكون مقاومة الأنودات الطويلة الرفيعة أقل من مقاومة الأنودات القصيرة السميكة، حيث إنها تصرف كمية أكبر من التيار ولكنها لا تدوم لفترة مماثلة.
لذلك يجب على مصمم الحماية الكاثودية تحجيم الأنودات بحيث يكون لها شكل مناسب ومساحة سطح كافية لإخراج تيار كافٍ لحماية الهيكل، ويكون وزنها كافٍ لتدوم للفترة المطلوبة عند تصريف التيار.
وكقاعدة عامة:
يحدد طول الأنود مقدار التيار الذي يمكن أن ينتجه الأنود، وبالتالي عدد الأمتار المربعة من الصلب التي يمكن حمايتها.
يحدد القطاع العرضي (الوزن) مدى الوقت الذي يمكن للأنود خلاله المحافظة على هذا المستوى من الحماية.
أنظمة الحماية الكاثودية بالتيار المسلط
أنودات من نوع معين لا يسهل إذابتها في الأيونات المعدنية، ولكنها تدعم تفاعلاً بديلاً، وهو أكسدة أيونات الكلوريد المذابة.
يتم توفير الطاقة عن طريق وحدة تيار مباشر خارجية.
2Cl- => Cl2 + 2e-

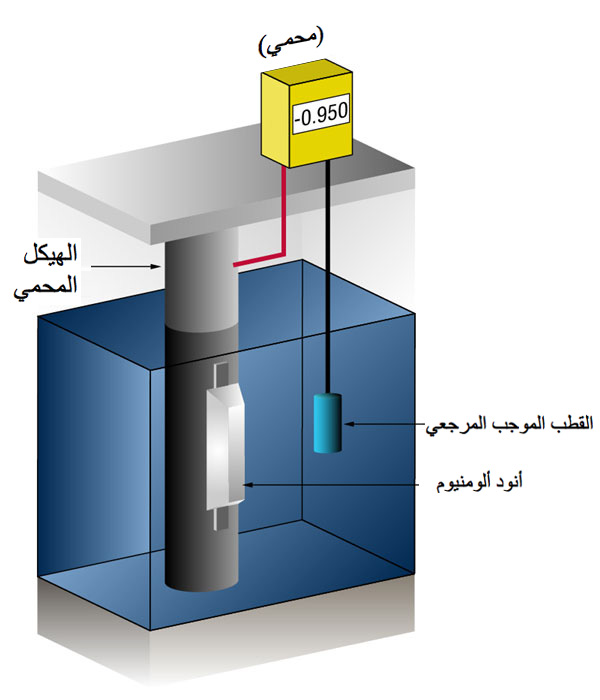
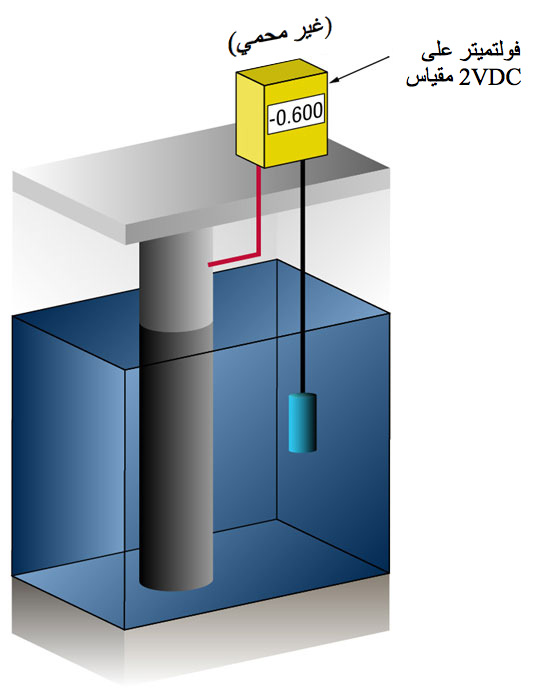
كيف لنا أن نعرف عندما يكون لدينا ما يكفي من الحماية الكاثودية؟
الفضة (Ag/AgCl sw.) ولكن في بعض الأحيان يكون هذا القطب هو الزنك (Zn sw.).
يعمل تدفق التيار في أي معدن على تحويل جهده العادي في الاتجاه السلبي.
لقد أثبت التاريخ أنه إذا تلقى الصلب تيارًا كافيًا لتغيير فرق الجهد إلى (-) 0.800 فولت مقابل الفضة/كلوريد الفضة، فإن التآكل يتوقف أساسًا.
نظرًا لطبيعة الأغشية التي تتكون، فإن الحد الأدنى لفرق الجهد (-0.800 فولت) نادرًا ما يكون هو فرق الجهد الأمثل، ويحاول المصممون تحقيق جهد بين (-) 0.950 و(-) 1.000 فولت مقابل الفضة/كلوريد الفضة..
 |
 |









