海上阴极保护 101:
它是什么以及它的工作原理是什么?
作者
Richard Baxter 和 Jim Britton
钢在海水中是如何受腐蚀的?
为了理解阴极保护,首先必须要了解腐蚀机理。发生腐蚀必须具备三个条件。 1. 两种不同的金属 2. 一种电解质(溶解有一种或多种类型盐的水) 3. 不同金属间存在金属(导电)通路 两种不同的金属可以是完全不同的合金,如钢和铝,但更常见的情况是一整块钢表面上微观或宏观的冶金学差异。 如果上述条件存在,那么在较活泼的金属表面(我们这里考虑非均质的自由腐蚀钢的情况)上,就会在较活泼的位置发生下列反应:(2 个铁离子 + 4 个自由电子)
2Fe => 2Fe++ + 4e-
自由电子通过金属通路,到达较不活泼的位置,在此处将发生下列反应: (氧气结合四个自由电子转化为氧离子,进而与水结合形成氢氧根离子)
O2 + 4e- + 2H20 => 4 OH-
在活泼的表面,这些离子重新结合后产生以下反应,从而得到铁的腐蚀产物氢氧化亚铁 (铁与氧气和水结合形成氢氧化亚铁)
2Fe + O2 + 2H2O => 2Fe (OH)2
这种反应更普遍解释为电流通过水从阳极(较活泼的位置)流向阴极(较不活泼的位置)。
阴极保护如何防止腐蚀?
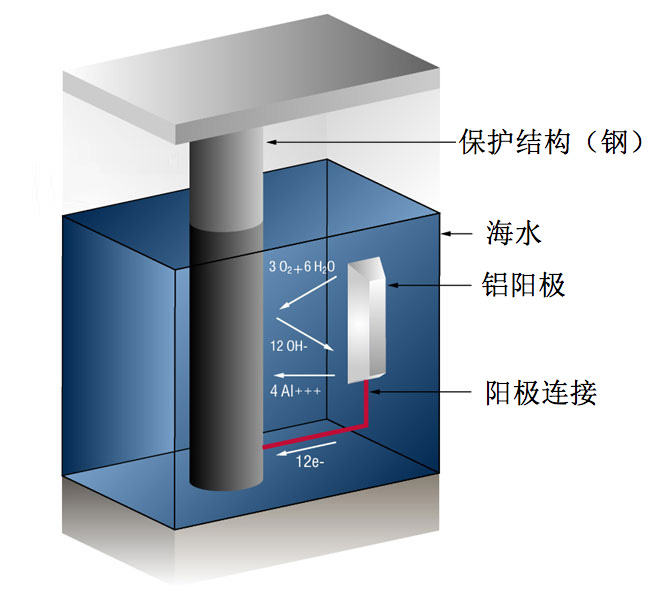
阴极保护通过以下方式防止腐蚀:从备用源向金属表面上的所有阳极(活化)位置提供电流(或自由电子),从而将其转换为阴极(钝化)位置。 通常,这是以比钢更为活泼的牺牲阳极的形式出现。这种做法也称为牺牲系统,因为牺牲阳极牺牲自身以保护钢结构或管道免遭腐蚀。 对于铝阳极而言,在铝表面发生的反应是:(4 个铝离子 + 12 个自由电子)
4Al => 4Al+++ + 12 e-
而在钢表面,(氧气转化为氧离子,进而与水结合形成氢氧根离子)
3O2 + 12e- + 6H20 => 12OH-
只要电流(自由电子)比氧气更快的到达阴极(钢),就不会发生腐蚀。
设计牺牲阳极系统的基本考虑
阳极释放的电流遵守欧姆定律;即:
I=E/R
式中: I= 电流(单位:安培) E= 阳极和阴极之间的电势差(单位:伏特) R= 总的回路电阻(单位:欧姆)
由于初始时阳极和阴极之间的电势差高,初始电流会比较高,但电势差随着电流流向阴极而下降,电流则因阴极的极化而逐渐下降。
回路电阻包括水通路和金属通路(包括回路中的所有电缆)。这里最主要的是阳极和海水之间的阻抗。
在绝大多数应用中,与水的电阻相比,金属电阻很小以至于可以忽略。(对于滑道或两端受保护的长管道而言并非如此)。
在一般情况下,细长阳极的阻抗比粗短阳极更小。这种电极将释放更多的电流,但耐久性较差。
因此,阴极保护设计者必须确定阳极尺寸,使其具有合适的形状和表面积,以释放足够的电流来保护结构,并且重量要足以保证其在预期寿命内始终释放出电流。
一般经验法则是:
阳极的长度决定了阳极能够产生多少电流,因而决定了能够保护多大面积的钢。
横截面(重量)决定阳极能够使这一保护水平维持多久
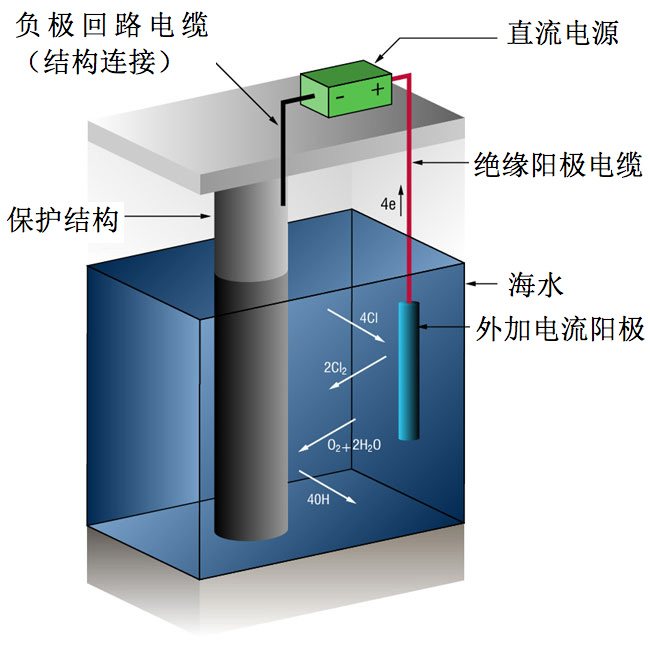
外加电流阴极保护系统
由于在许多海水系统中存在大电流,因此使用外加电流系统并不少见。外加电流系统所使用的阳极类型通常不易溶为金属离子,而是维持一个替代反应,氧化溶解出氯离子。 (由外部直流电源装置进行供电。 )
2Cl- => Cl2 + 2e-
Power is supplied by an external DC power unit.
如何知道阴极保护何时足够呢?
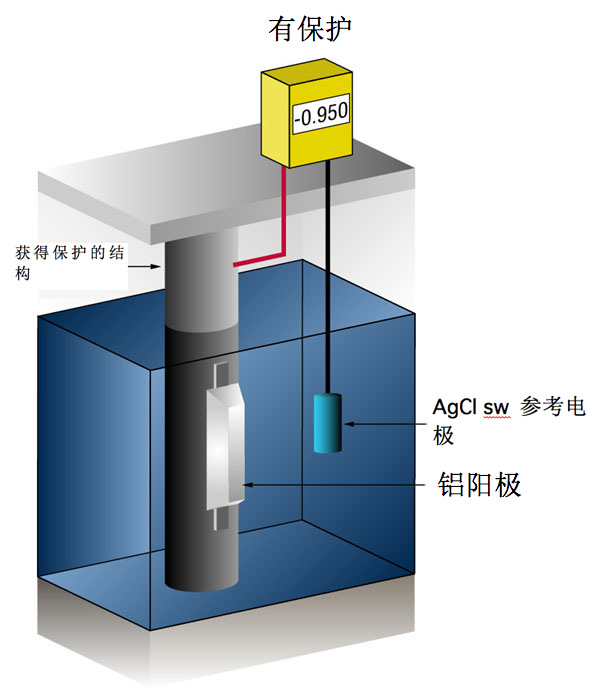
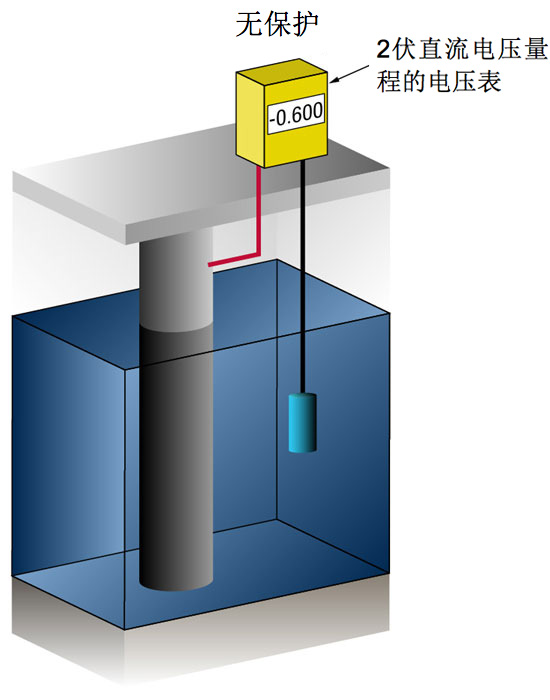
通过测量标准参考电极[通常为银/氯化银(Ag/AgCl sw.),但有时使用锌(Zn sw.)]与钢之间的电势,即可知晓是否获得了足够的电流。
任何流向金属的电流都会使其标准电势更负。
既往经验表明,如果钢获得足够的电流使其电势达到 (-) 0.800 V(相对于银/氯化银),基本上即可防止腐蚀。
鉴于所形成薄膜的性质,最小电势 (-0.800 V) 很少是最佳电势,设计者尽量使电势达到 (-) 0.950 V 至 (-) 1.000 V (相对于 Ag/AgCl sw)。
 |
 |









