Protección Catódica Costa Fuera
¿QUÉ ES Y CÓMO FUNCIONA?
Richard Baxter, Jim Britton
¿Cómo se corroe el acero en el agua marina?
Para entender la protección catódica, primero debemos entender el mecanismo de corrosión. For corrosion to occur, three conditions must be present. Para que ocurra corrosión, se deben cumplir tres condiciones.
- Dos metales disimilares
- Un electrolito (agua con algún tipo de sal o sales disueltas en ella)
- Un trayecto metálico (conductor) entre los metales disimilares
Los dos metales disimilares pueden ser aleaciones totalmente diferentes, como las de acero y aluminio, pero generalmente se trata más de diferencias metalúrgicas microscópicas o macroscópicas en la superficie de una pieza única de acero.
Si existen las condiciones anteriores en la superficie metálica más activa (en este caso consideraremos el acero que se corroe libremente, el cual no es uniforme), la siguiente reacción ocurre en los sitios más activos (2 iones de hierro más 4 electrones libres):2Fe => 2Fe++ + 4e-
Los electrones libres viajan a través del trayecto metálico hacia los sitios menos activos donde ocurre la siguiente reacción (Gas oxígeno convertido en ion oxígeno, al combinarse con los cuatro electrones libres, el cual se combina con agua para formar iones hidroxilo):
O2 + 4e- + 2H20 => 4 OH-
Las recombinaciones de estos iones en la superficie activa producen la siguiente reacción, la cual produce el producto de corrosión del hierro hidróxido ferroso.
2Fe + O2 + 2H2O => 2Fe (OH)2
Esta reacción se explica más comúnmente como flujo de corriente a través del agua desde el ánodo (lugar más activo) hacia el cátodo (lugar menos activo).
¿Cómo la protección catódica detiene la corrosión?
La protección catódica previene la corrosión al convertir todos los sitios anódicos (activos) de la superficie metálica en sitios catódicos (pasivos) mediante el suministro de corriente eléctrica (o electrones libres) desde una fuente alterna.
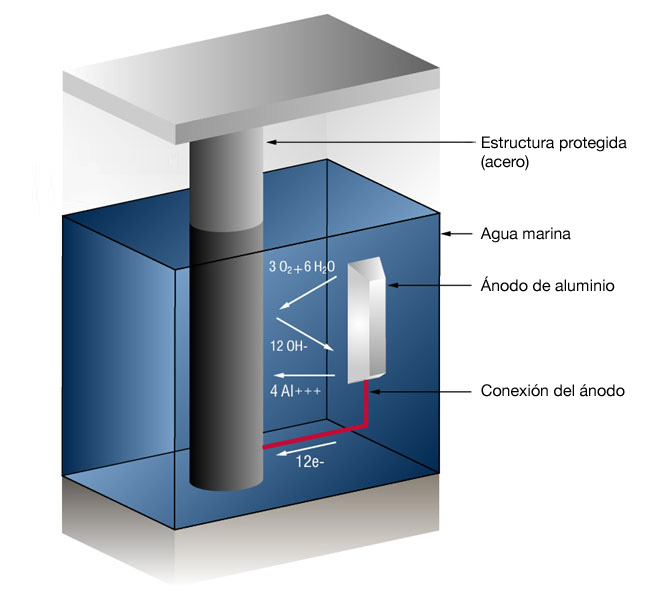
Generalmente esto toma la forma de ánodos galvánicos que son más activos que el acero. Este método también se conoce como sistema de protección catódica por ánodos de sacrificio, ya que los ánodos galvánicos se sacrifican a sí mismos para proteger el acero estructural o la tubería de la corrosión.
En el caso de los ánodos de aluminio, la reacción en la superficie de aluminio es (4 iones de aluminio más 12 electrones libres):
4Al => 4AL+++ + 12 e-
y en la superficie metálica (Gas oxígeno convertido en iones de oxígeno que se combinan con agua para formar iones hidroxilo):
3O2 + 12e- + 6H20 => 12OH-
Siempre que la corriente (electrones libres) llegue al cátodo (acero) más rápido que el oxígeno, no se presenta corrosión.
Figura 1: Sistema de protección catódica por ánodo de sacrificio en agua marina
Consideraciones básicas para el diseño de sistemas de protección catódica
por ánodos de sacrificio
La corriente eléctrica que un ánodo descarga es controlada por la ley de Ohm, es decir:
I=E/R
Donde:
I= Flujo de corriente en amperios
E= Diferencia de potencial entre el ánodo y el cátodo en voltios
R= Resistencia total del circuito en ohmios
Inicialmente, la corriente será alta debido a que la diferencia de potencial entre el ánodo y el cátodo es alta, pero a medida que la diferencia de potencial disminuye debido al efecto del flujo de corriente hacia el cátodo, la corriente disminuye gradualmente debido a la polarización del cátodo.
La resistencia del circuito incluye tanto el trayecto del agua como el trayecto del metal, incluido cualquier cable en el circuito. El valor dominante en este caso es la resistencia del ánodo al agua de mar. Para la mayoría de las aplicaciones, la resistencia del metal es tan reducida en comparación con la resistencia del agua que puede ignorarse. (Esto no se aplica para trineos o tuberías largas protegidas desde ambos extremos).
En general, los ánodos largos y delgados tienen menor resistencia que los ánodos cortos y gruesos. Éstos descargarán más corriente, pero no durarán tanto tiempo. Por lo tanto, el diseñador de protección catódica debe determinar el tamaño de los ánodos de manera que tengan la forma y el área de superficie correctas para descargar suficiente corriente a fin de proteger la estructura, y el peso adecuado para durar el tiempo deseado cuando descarguen esta corriente.
Como regla general: La Longitud del ánodo determina cuánta corriente puede producir y, por consiguiente, cuántos metros cuadrados de acero pueden protegerse. La sección transversal (peso) determina por cuánto tiempo el ánodo puede mantener este grado de protección.
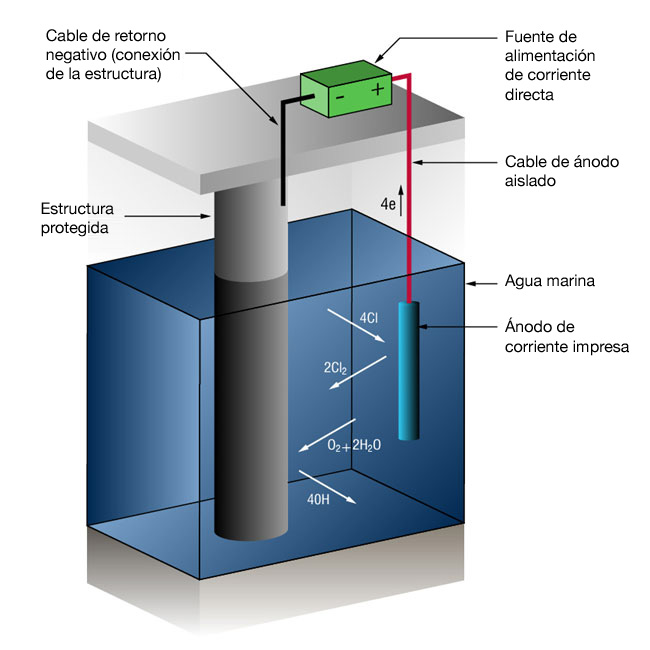
Sistemas de protección catódica por corriente impresa
Debido a las altas corrientes involucradas en muchos sistemas de agua marina, no es inusual utilizar sistemas de corriente impresa. Los sistemas de corriente impresa utilizan una clase de ánodos que no se disuelven fácilmente en iones metálicos, sino que mantienen una reacción alternativa: la oxidación de los iones de cloruro disueltos.
2Cl- => Cl2 + 2e-
Una unidad externa de potencia de corriente directa suministra la corriente.
Figura 2: Sistema de protección catódica de corriente impresa
¿Cómo sabemos que tenemos suficiente protección catódica?
Sabemos que tenemos o no suficiente corriente si comparamos el potencial del acero con el de un electrodo de referencia estándar, generalmente de plata/cloruro de plata (Ag/AgCl agua marina), pero algunas veces de zinc (Zn agua marina).
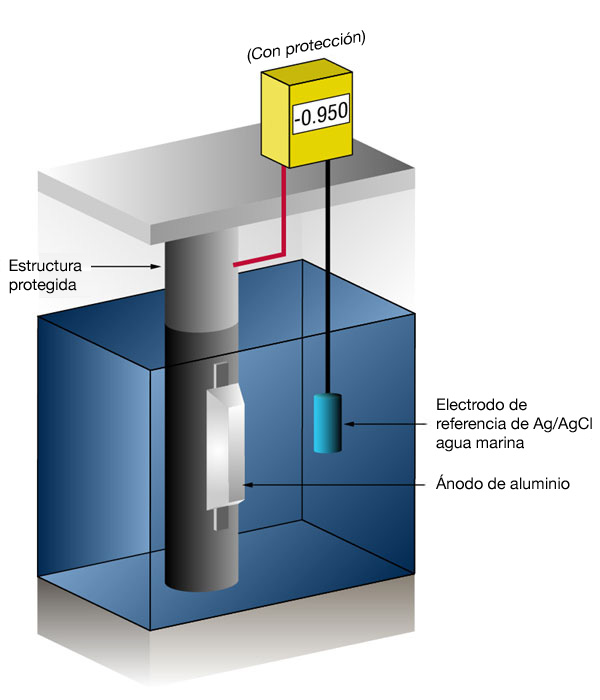
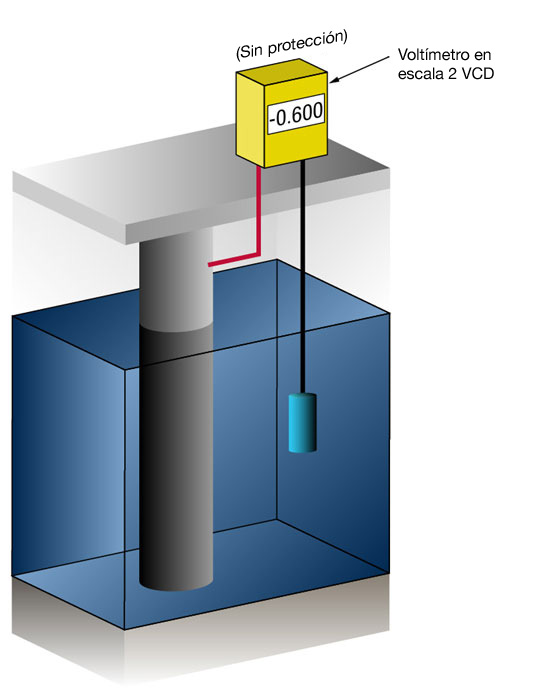
El flujo de corriente en cualquier metal cambia su potencial normal en la dirección negativa. La experiencia ha demostrado que si el acero recibe suficiente corriente para cambiar el potencial a (-) 0.800 V vs. plata/cloruro de plata, la corrosión esencialmente se detiene.
Debido a la naturaleza de las películas que se forman, el potencial mínimo (-0.800 V) es rara vez el potencial óptimo, y los diseñadores intentan lograr un potencial entre (-) 0.950 V y (-) 1.000 V vs. Ag/AgCl agua marina.
Figura 3: Medición del potencial de protección catódica (Sin protección a la izquierda – Con protección a la derecha)
 |
 |









