Protection Cathodique en Mer:
Définition et Fonctionnement.
Richard Baxter, Jim Britton
Comment se développe la corrosion de l'acier dans l'eau de mer?
Pour comprendre la protection cathodique, il faut d'abord comprendre le mécanisme de la corrosion. Pour que la corrosion puisse se produire, trois conditions doivent être présentes.
1. Deux métaux différents
2. Un électrolyte (de l'eau avec n'importe quel type de sel ou des sels dissouts dedans)
3. Un parcours de métal (conducteur) entre les différents métaux
Les deux différents métaux peuvent être des alliages totalement différents, tels que l'acier et l'aluminium mais en principe les différences sont métallurgiques au niveau microscopique ou macroscopique sur la surface d'une seule pièce d'acier.
Si les conditions susmentionnées sont présentes, au niveau de la surface métallique la plus active (dans ce cas, nous allons considérer de l'acier librement corrosif qui n'est pas uniforme), la réaction suivante se produit au niveau des sites les plus actifs : (2 ions de fer plus 4 électrons libres)
2Fe => 2Fe++ + 4e-
Les électrons libres passent par le parcours de métal en direction de sites moins actifs où la réaction suivante a lieu : (L'oxygène est converti en ions d'oxygène [en l'associant aux quatre électrons libres] qui se mélangent ensuite à l'eau pour former des ions d'hydroxyle)
O2 + 4e- + 2H20 => 4 OH-
Les recombinaisons de ces ions au niveau de la surface active produisent la réaction suivante qui crée l'hydroxyde ferreux, produit issu de la corrosion du fer (Le fer associé à l'oxygène et l'eau pour former de l'hydroxyde ferreux)
2Fe + O2 + 2H2O => 2Fe (OH)2
Cette réaction est généralement décrite comme le courant traversant l'eau de l'anode (site plus actif) vers la cathode (site moins actif).
Dans quelles mesures la protection cathodique est capable d'arrêter la corrosion?
La protection cathodique empêche la corrosion en convertissant tous les sites (actifs) anodiques de la surface métallique en sites cathodiques (passifs) par le biais du courant électrique (ou électrons libres) provenant d'une source alternative.
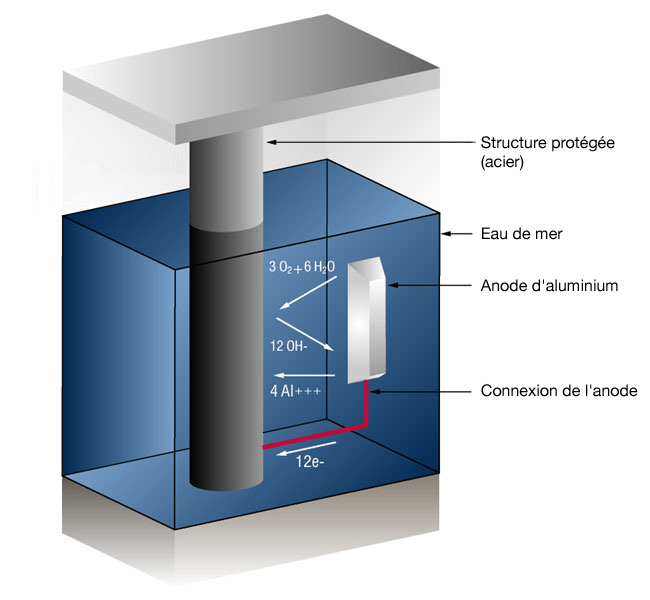
Cette conversion prend généralement la forme d'anodes galvaniques qui sont plus actives que l'acier. Cette pratique est également désignée sous le nom de système sacrificiel, puisque les anodes galvaniques se sacrifient pour protéger l'acier ou les pipelines contre la corrosion. Dans le cas d'anodes d'aluminium, la réaction au niveau de la surface de l'aluminium est la suivante (4 ions d'aluminium plus 12 électrons libres) :
4Al => 4AL+++ + 12 e-
et sur la surface en acier (L'oxygène est converti en ions qui se mélangent à l'eau pour former des ions hydroxyles) :
3O2 + 12e- + 6H20 => 12OH-
Tant que le courant (électrons libres) arrive à la cathode (acier) plus rapidement que l'oxygène, aucune corrosion ne se produira.
Figure 1 : Système CP d'anodes sacrificielles dans l'eau de mer
Facteurs élémentaires à inclure dans la conception de
systèmes
à anodes sacrificielles
Le courant électrique qu'une anode décharge est régi par la loi d'Ohm; à savoir :
I=E/R
Où :
I= Courant en ampères
E= Différence dans le potentiel entre l'anode et la cathode en volts
R = Résistance totale du circuit en ohms
Au début, le courant sera élevé puisque la différence de potentiel entre l'anode et la cathode est élevée, mais à mesure que la différence de potentiel diminue suite à l'impact du courant sur la cathode, le courant diminue graduellement en raison de la polarisation de la cathode.
La résistance du circuit inclut le parcours de l'eau et celui du métal, y compris tous les câbles faisant partie du circuit.
Ici, la valeur dominante est la résistance de l'anode à l'eau de mer.
Pour la plupart des applications, la résistance des métaux est si faible comparée à la résistance de l'eau qu'elle peut être ignorée. (Ce n'est toutefois pas le cas des traîneaux ou des longs pipelines protégés aux deux extrémités).
En principe, la résistance des anodes longues et minces est inférieure à celle des anodes épaisses et courtes. Elles déchargeront plus de courant, mais ne dureront pas aussi longtemps.
En conséquence, un concepteur en protection cathodique doit concevoir les anodes de sorte qu'elles aient la forme et la superficie adéquates pour décharger suffisamment de courant et pour protéger la structure ainsi que le poids requis pour que leur vie utile corresponde aux spécifications de décharge de courant.
En règle générale : La longueur de l'anode détermine la quantité de courant que l'anode est capable de produire et en conséquence, la superficie en pieds carrés d'acier qui peut être protégée. La section transversale (poids) détermine la durée pendant laquelle l'anode est capable de soutenir ce niveau de protection.
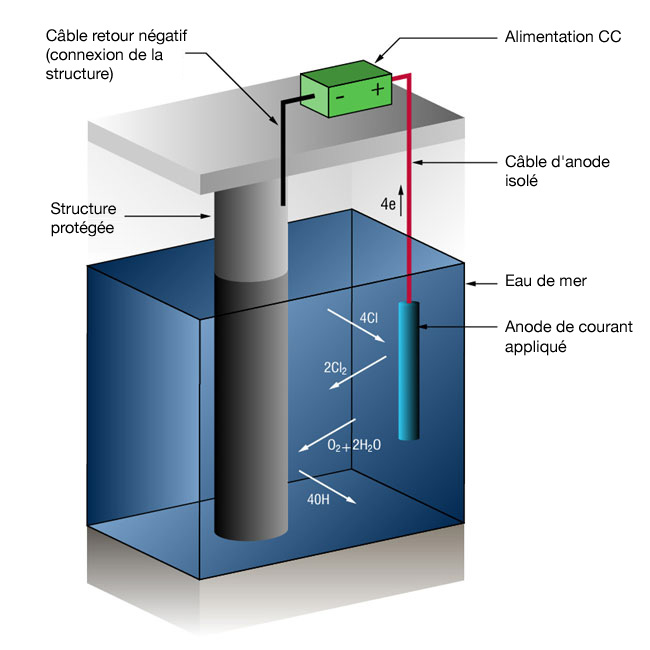
Systèmes de protection cathodique à courant appliqué
En raison des courants élevés impliqués dans beaucoup de systèmes d'eau de mer, il n'est pas rare d'utiliser des systèmes à courant appliqué. Les systèmes à courant appliqué utilisent les anodes d'un type qui ne se dissout pas facilement dans les ions métalliques, mais soutient plutôt une réaction alternative, qui est l'oxydation des ions de chlorure dissous.
2Cl- => Cl2 + 2e-
L'alimentation est fournie par une unité CC externe.
Comment peut-on déterminer si la protection cathodique est suffisante?
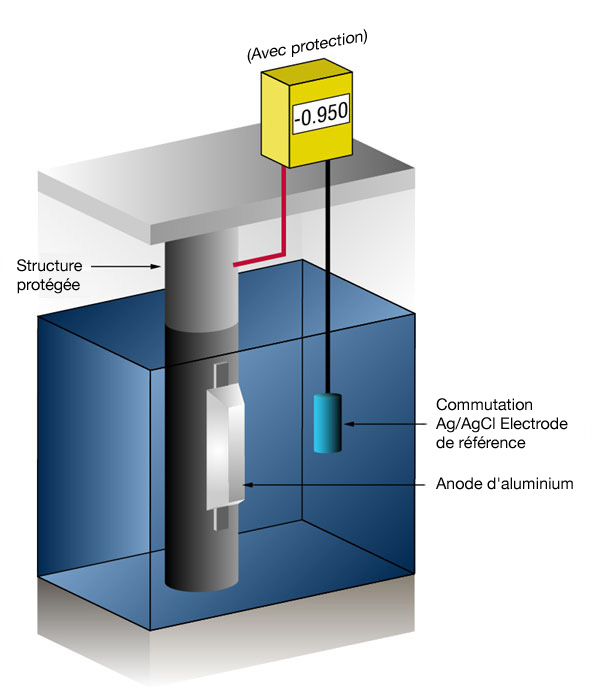
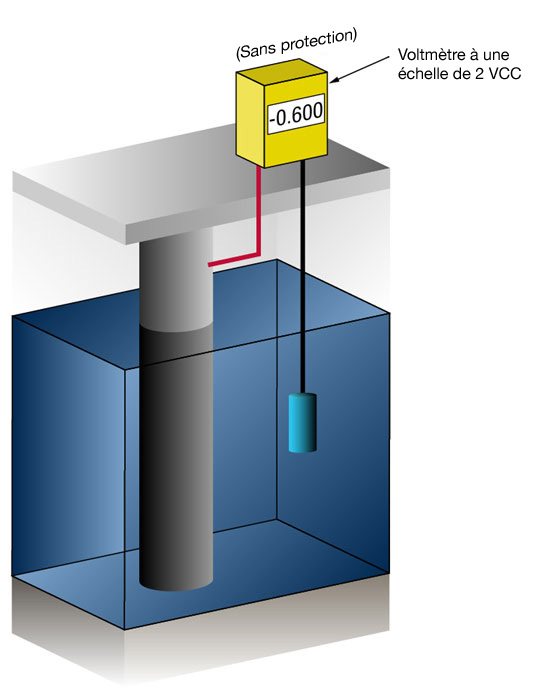
Nous savons si nous avons suffisamment de courant en mesurant le potentiel de l'acier par rapport à une électrode standard de référence, en principe l'argent/le chlorure d'argent (commutation Ag/AgCl), mais parfois le zinc (commutation Zn).
Le courant dans n'importe quel métal décale son potentiel normal dans la direction négative.
L'histoire a montré que si l'acier reçoit suffisamment de courant pour décaler le potentiel vers (-) 0,800 V par rapport à l'argent/chlorure d'argent, la corrosion cesse.
En raison de la nature des films formés, le potentiel minimum (0,800 V) est rarement le potentiel optimum, et les concepteurs essayent de réaliser un potentiel entre (-) 0,950 V et (-) 1,000 V par rapport à la commutation d'Ag/AgCl.
 |
 |









